บทที่2อะตอมและสมบัติของธาตุ
2.1แบบจำลองอะตอม
แบบจำลองอะตอมของดอลตัน
จอห์น ดอลตัน (John Dalton) นักวิทยาศาสตร์ชาวอังกฤษได้เสนอทฤษฎีว่า อะตอมมีลักษณะทรงกลม
ภายในว่างเล่า เป็นอนุภาคที่มีขนาดเล็กที่สุด แบ่งแยกไม่ได้ และไม่สามารถสร้างขึ้นใหม่หรือทำให้สูญหายไปได้ อะตอมของธาตุชนิดเดียวกันย่อมมีสมบัติเหมือนกัน มีมวลเท่าๆ กัน
หลอดรังสีแคโทด
เป็นเครื่องที่ใช่ทดลองเกี่ยวกับการนำไฟฟ้าโดยหลอดรังสีแคโทดจะมีความดันต่ำมาก และความต่างศักย์สูงมาก วิลเลียม ครูกส์ได้สร้างหลอดรังสีแคโทดขึ้นมาโดยใช้แผ่นโลหะ 2 แผ่นเป็นขั้วไฟฟ้า โดยต่อขั้วไฟฟ้าลบกับขั้วลบของเครื่องกำเนิดไฟฟ้าเรียกว่า แคโทด และต่อขั้วไฟฟ้าบวกเข้ากับขั้วบวกของเครื่องกำเนิดไฟฟ้าเรียกว่า แอโนด
ผลการทดลองของโกสไตน์
สรุปแบบจำลองของทอมสัน
ลอร์ดเออร์เนสต์ รัทเทอร์ฟอร์ด ได้ทำการทดลอง โดยการยิงอนุภาคแอลฟาไปยังแผ่นทองคำดังรูป
1. เนื่อจากมวลของอะตอมต่าง มักเป็น 2 เท่า หรือมากกว่า 2 เท่าของมวลโปรตรอนรวม
รัทเทอร์ฟอร์ดสันนิษฐานว่า น่าจะมีอนุภาคอีกชนิดหนึ่งอยู่ในนิวเคลียส และอนุภาคนี้
ต้องมีมวลใกล้เคียงกันกับมวลของโปรตรอนมาก และต้องเป็นกลางทางไฟฟ้า
2. ทอมสันศึกษาหามวลของอนุภาคบวกของ Ne ปรากฎว่า อนุภาคบวกนี้มีมวล 2 เท่า
ผลการทดลองนี้สนับสนุนว่าจะต้องมีอนุภาคอีกชนิดหนึ่งอยู่ในนิวเคลียส
เชดวิก ได้ยิงอนุภาคแอลฟาไปยัง Be ปรากฎว่าได้อนุภาคชนิดนึ่งออกมา
ซึ่งมีมวลใกล้เคียงกับมวลของโปรตรอนและไม่มีประจุไฟฟ้า เรียกอนุภาคนี้ว่า"นิวตรอน"
สรุปแบบจำลองอะตอมของรัทเทอร์ฟอร์ด
ผลการทดลอง
อิเล็กตรอนเคลื่อนจากขั้วบวกไปขั้วลบชนกับแก๊สไฮโดรเจน จากนั้นเปล่งแสงออกมาผ่านปริซึมทำให้เราเห็นเป็นเส้นสเปกตรัมสีต่าง ๆ ตกบนฉากรับภาพ
สรุปผลการทดลอง
การเปล่งแสงของธาตุไฮโดรเจน เกิดจากอิเล็กตรอนเปลี่ยนระดับพลังงานจากวงโคจรสูงไปสู่วงโคจรต่ำ พร้อมทั้งคายพลังงานในรูปแสงสีต่าง ๆ
สรุปแบบจำลองอะตอมของโบร์
1. อิเลคตรอนจะอยู่กันเป็นชั้น ๆ แต่ละชั้นเรียกว่า “ระดับพลังงาน”
2. อิเลคตรอนที่อยู่ในระดับพลังงานวงนอกสุดเรียกว่า เวเลนซ์อิเลคตรอน (Valent electron)จะเป็นอิเลคตรอน
ที่เกิดปฏิกิริยาต่าง ๆ ได้
3. อิเลคตรอนที่อยู่ในระดับพลังงานวงในอยู่ใกล้นิวเคลียส จะเสถียรมากเพราะประจุบวกจากนิวเคลียสดึงดูด
ไว้อย่างดี ส่วนอิเลคตรอนระดับพลังงานวงนอจะไม่เสถียรเพราะนิวเคลียสส่งแรงไปดึงดูดได้น้อยมาก
4. ระดับการพลังงานวงในจะอยู่ห่างกันมาก ส่วนระดับพลังงานวงนอกจะอยู่ชิดกันมาก
5. การเปลี่ยนระดับพลังงานของอิเลคตรอน ไม่จำเป็นต้องเปลี่ยนในระดับถัดกัน อาจเปลี่ยนข้ามระดับ
พลังงานกันก็ได้
ภายในว่างเล่า เป็นอนุภาคที่มีขนาดเล็กที่สุด แบ่งแยกไม่ได้ และไม่สามารถสร้างขึ้นใหม่หรือทำให้สูญหายไปได้ อะตอมของธาตุชนิดเดียวกันย่อมมีสมบัติเหมือนกัน มีมวลเท่าๆ กัน
แบบจำลองอะตอมของทอมสัน
เซอร์โจเซฟ จอห์น ทอมสัน นักวิทยาศาสตร์ชาวอังกฤษ ได้ทำการศึกษาและทดลองเกี่ยวกับการนำไฟฟ้าของก๊าซโดยใช้หลอดรังสีแคโทด
เป็นเครื่องที่ใช่ทดลองเกี่ยวกับการนำไฟฟ้าโดยหลอดรังสีแคโทดจะมีความดันต่ำมาก และความต่างศักย์สูงมาก วิลเลียม ครูกส์ได้สร้างหลอดรังสีแคโทดขึ้นมาโดยใช้แผ่นโลหะ 2 แผ่นเป็นขั้วไฟฟ้า โดยต่อขั้วไฟฟ้าลบกับขั้วลบของเครื่องกำเนิดไฟฟ้าเรียกว่า แคโทด และต่อขั้วไฟฟ้าบวกเข้ากับขั้วบวกของเครื่องกำเนิดไฟฟ้าเรียกว่า แอโนด
การค้นพบอิเล็กตรอน
เซอร์โจเซฟ จอห์น ทอมสัน ดัดแปลงหลอดรังสีใหม่ ดังรูป
รังสีพุ่งจากด้าแคโทดไปยังด้านแอโนด และจะมีรังสีส่วนหนึ่งทะุลุออกไปกระทบกับฉากเรืองแสง
หลังจากนั้นทอมสันได้เพิ่มขั้วไฟฟ้าเข้าไปในหลอดรังสีแคโทดดังรูป
ปรากฎว่า รังสีนี้จะเบี่ยงเบนเข้าหาขั้วบวก แสดงว่า รังสีนี้ต้องเป็นประจุลบ แต่ไม่ทราบว่าเกิดจากก๊าซในหลอดรังสีแคโทด หรือเกิดจากขั้วไฟฟ้าทอมสันจึงทำการทดลองเกี่ยวกับการนำไฟฟ้าของก๊าซในหลอดรังสีแคโทด พบว่า ไม่ว่าจะใช้ก๊าซใดบรรจุในหลอดหรือใช้โลหะใดเป็นแคโทด จะได้ผลการทดลองเหมือนเดิม จึงสรุปได้ว่า อะตอมทุกชนิดมีอนุภาคที่มีประจุลบเป็นองค์ประกอบ เรียกว่า "อิเล็กตรอน"
การค้นพบโปรตอน
เนื่องจากอะตอมเป็นกลางทางไฟฟ้า และการที่พบว่าอะตอมของธาตุทุกชนิดประกอบด้วยอิเล็กตรอนซึ่งมีประจุไฟฟ้าเป็นลบ ทำให้นักวิทยาศาสตร์เชื่อว่าองค์ประกอบอีกส่วนหนึ่งของอะตอม จะต้องมีประจุบวกด้วย ออยแกน โกลด์สไตน์ (Eugen Goldstein) นักวิทยาศาสตร์ชาวเยอรมัน ได้ทดลองเกี่ยวกับหลอดรังสีแคโทด โดยดัดแปลงหลอดรังสีแคโทด ดังรูป
ผลการทดลองของโกสไตน์
เมื่อผ่านกระแสไฟฟ้า ปรากฏว่ามีจุดสว่างเกิดขึ้นทั้งฉากเรืองแสง ก. และฉากเรืองแสง ข.
โกลสไตน์ได้อธิบายว่า จุดเรืองแสงที่เกิดขึ้นบนฉากเรืองแสง ก. จะต้องเกิดจากที่ประกอบด้วยอนุภาคที่มีประจุไฟฟ้าบวก เคลื่อนที่ผ่านรูตรงกลางของแคโทด ไปยังฉากเรืองแสง แต่ยังไม่ทราบว่ารังสีที่มีประจุไฟฟ้าบวกนี้เกิดจากอะตอมของก๊าซ หรือเกิดจากอะตอมของขั้วไฟฟ้า และมีลักษณะเหมือนกันหรือไม่
โกลสไตน์ได้ทดลองเปลี่ยนชนิดของก๊าซในหลอดแก้วปรากฏว่าอนุภาคที่มีประจุไฟฟ้าบวกเหล่านี้มีอัตราส่วนประจุต่อมวลไม่เท่ากัน ขึ้นอยู่กับชนิดของก๊าซที่ใช้และเมื่อทดลองเปลี่ยนโลหะที่ใช้ทำเป็นขั้วไฟฟ้าหลายๆชนิดแต่ให้ก๊าซในหลอดแก้วชนิดเดียวกัน ปรากฏว่า ผลการทดลองได้อัตราส่วนประจุต่อมวลเท่ากันแสดงว่าอนุภาคบวกในหลอดรังสีแคโทดเกิดจากก๊าซ
ไม่ได้เกิดจากขั้วไฟฟ้า
โกลสไตน์ได้อธิบายว่า จุดเรืองแสงที่เกิดขึ้นบนฉากเรืองแสง ก. จะต้องเกิดจากที่ประกอบด้วยอนุภาคที่มีประจุไฟฟ้าบวก เคลื่อนที่ผ่านรูตรงกลางของแคโทด ไปยังฉากเรืองแสง แต่ยังไม่ทราบว่ารังสีที่มีประจุไฟฟ้าบวกนี้เกิดจากอะตอมของก๊าซ หรือเกิดจากอะตอมของขั้วไฟฟ้า และมีลักษณะเหมือนกันหรือไม่
โกลสไตน์ได้ทดลองเปลี่ยนชนิดของก๊าซในหลอดแก้วปรากฏว่าอนุภาคที่มีประจุไฟฟ้าบวกเหล่านี้มีอัตราส่วนประจุต่อมวลไม่เท่ากัน ขึ้นอยู่กับชนิดของก๊าซที่ใช้และเมื่อทดลองเปลี่ยนโลหะที่ใช้ทำเป็นขั้วไฟฟ้าหลายๆชนิดแต่ให้ก๊าซในหลอดแก้วชนิดเดียวกัน ปรากฏว่า ผลการทดลองได้อัตราส่วนประจุต่อมวลเท่ากันแสดงว่าอนุภาคบวกในหลอดรังสีแคโทดเกิดจากก๊าซ
ไม่ได้เกิดจากขั้วไฟฟ้า
สรุปแบบจำลองของทอมสัน
จากผลการทดลอง ทั้งของทอมสันและโกลด์สไตน์ ทำให้ทอมสันได้ข้อมูลเกี่ยวกับอะตอมมากขึ้น จึงได้เสนอแบบจำลองอะตอม ดังนี้ อะตอมมีลักษณะเป็นทรงกลมประกอบด้วยอนุภาคโปรตอนที่มีประจุไฟฟ้าเป็นบวกและอนุภาคอิเล็กตรอนที่มีประจุไฟฟ้าเป็นลบ กระจัดกระจายอย่างสม่ำเสมอในอะตอมอะตอมที่มีสภาพเป็นกลางทางไฟฟ้าจะมีจำนวนประจุบวกเท่ากับจำนวนประจุลบ
แบบจำลองอะตอมของรัทเทอร์ฟอร์ด
ลอร์ดเออร์เนสต์ รัทเทอร์ฟอร์ด ได้ทำการทดลอง โดยการยิงอนุภาคแอลฟาไปยังแผ่นทองคำดังรูป
ผลการทดลอง สรุปได้ดังนี้
• จุด X เป็นจุดที่อนุภาคแอลฟาผ่านไปยังฉากในแนวเส้นตรง แสดงว่า ภายในอะตอมน่าจะมีพื้นที่ว่างเป็นจำนวนมาก เพราะ อนุภาคแอลฟาส่วนใหญ่ทะลุผ่านแผนทองคำเป็นแนวเส้นตร
ง
ง
• จุด Y อนุภาคแอลฟาเบี่ยงเบนเล็กน้อย แสดงว่าภายในอะตอมควรมีอนุภาคบางอย่างรวมกันเป็นกลุ่มก้อนขนาดเล็ก มีมวลมากพอที่ทำให้อนุภาคแอลฟาวิ่งไปเฉียดแล้วเบี่ยงเบน
• จุด Z อนุภาคแอลฟาสะท้อนกลับ แสดงว่าในอะตอมจะมีอนุภาคบางอย่างที่เป็นกลุ่มก้อน มีทวลมากพอที่ทำให้อนุภาคแอลฟาสะท้อนกลับ
การค้นพบนิวตรอน
สาเหตุที่ค้นพบนิวตรอน1. เนื่อจากมวลของอะตอมต่าง มักเป็น 2 เท่า หรือมากกว่า 2 เท่าของมวลโปรตรอนรวม
รัทเทอร์ฟอร์ดสันนิษฐานว่า น่าจะมีอนุภาคอีกชนิดหนึ่งอยู่ในนิวเคลียส และอนุภาคนี้
ต้องมีมวลใกล้เคียงกันกับมวลของโปรตรอนมาก และต้องเป็นกลางทางไฟฟ้า
2. ทอมสันศึกษาหามวลของอนุภาคบวกของ Ne ปรากฎว่า อนุภาคบวกนี้มีมวล 2 เท่า
ผลการทดลองนี้สนับสนุนว่าจะต้องมีอนุภาคอีกชนิดหนึ่งอยู่ในนิวเคลียส
เชดวิก ได้ยิงอนุภาคแอลฟาไปยัง Be ปรากฎว่าได้อนุภาคชนิดนึ่งออกมา
ซึ่งมีมวลใกล้เคียงกับมวลของโปรตรอนและไม่มีประจุไฟฟ้า เรียกอนุภาคนี้ว่า"นิวตรอน"
อะตอมประกอบด้วยนิวเคลียสที่มีโปรตอนรวมกันอยู่ตรงกลาง นิวเคลียสมีขนาดเล็ก แต่มีมวลมากและมีประจุเป็นบวก ส่วนอิเล็กตรอนซึ่งมีประจุเป็นลบ และมีมวลน้อยมาก จะวิ่งอยู่รอบนิวเคลียสเป็นบริเวณกว้าง
แบบจำลองอะตอมของโบร์
โบร์ได้ศึกษาแบบจำลองอะตอมขึ้นมาโดยนำแบบจำลองอะตอมของรัทฟอร์ดมาแก้ไข เขาศึกษาสเปกตรัมการเปล่งแสงของธาตุ โดยบรรจุแก๊สไฮโดรเจนในหลอดปล่อยประจุ จากนั้นให้พลังงานเข้าไป
ผลการทดลอง
สรุปผลการทดลอง
การเปล่งแสงของธาตุไฮโดรเจน เกิดจากอิเล็กตรอนเปลี่ยนระดับพลังงานจากวงโคจรสูงไปสู่วงโคจรต่ำ พร้อมทั้งคายพลังงานในรูปแสงสีต่าง ๆ
สรุปแบบจำลองอะตอมของโบร์
1. อิเลคตรอนจะอยู่กันเป็นชั้น ๆ แต่ละชั้นเรียกว่า “ระดับพลังงาน”
2. อิเลคตรอนที่อยู่ในระดับพลังงานวงนอกสุดเรียกว่า เวเลนซ์อิเลคตรอน (Valent electron)จะเป็นอิเลคตรอน
ที่เกิดปฏิกิริยาต่าง ๆ ได้
3. อิเลคตรอนที่อยู่ในระดับพลังงานวงในอยู่ใกล้นิวเคลียส จะเสถียรมากเพราะประจุบวกจากนิวเคลียสดึงดูด
ไว้อย่างดี ส่วนอิเลคตรอนระดับพลังงานวงนอจะไม่เสถียรเพราะนิวเคลียสส่งแรงไปดึงดูดได้น้อยมาก
4. ระดับการพลังงานวงในจะอยู่ห่างกันมาก ส่วนระดับพลังงานวงนอกจะอยู่ชิดกันมาก
5. การเปลี่ยนระดับพลังงานของอิเลคตรอน ไม่จำเป็นต้องเปลี่ยนในระดับถัดกัน อาจเปลี่ยนข้ามระดับ
พลังงานกันก็ได้
แบบจำลองอะตอมแบบกลุ่มหมอก
จากแบบจำลองอะตอมของโบร์ ไม่สามารถอธิบายสมบัติบางอย่างของธาตุที่มีหลายอิเล็กตรอนได้จึงมีการศึกษาเพิ่มเติมและเชื่อว่า อิเล็กตรอนมีสมบัติเป็นได้ทั้ง คลื่นและอนุภาคการศึกษาเพิ่มเติมและเชื่อว่า อิเล็กตรอนมีสมบัติเป็นได้ทั้ง คลื่นและอนุภาค
สรุปแบบจำลองอะตอมแบบกลุ่มหมอกแบบจำลองนี้เชื่อว่า
1. อิเล็กตรอนไม่ได้เคลื่อนที่เป็นวงกลม แต่เคลื่อนที่ไปรอบๆนิวเคลียส
เป็นรูปทรงต่างๆตามระดับพลังงาน
2. ไม่สามารถบอกตำแหน่งที่แน่นอนของอิเล็กตรอนไ้ด้ เนื่องจากอิเล็กตรอนมีขนาดเล็กมาก
และเคลื่อนที่รวดเร็วตลอดเวลาไปทั่วทั้งอะตอม
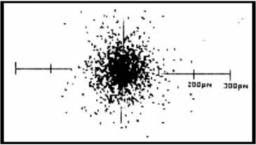
3. อะตอมประกอบด้วยกลุ่มหมอกของอิเล็กตรอนรอบนิวเคลียส บริเวณที่มีหมอกทึบ
แสดงว่ามีโอกาสพบอิเล็กตรอนได้มากกว่าบริเวณที่มีหมอกจาง ดังรูปที่แสดงไว้
สรุปแบบจำลองอะตอมแบบกลุ่มหมอกแบบจำลองนี้เชื่อว่า
1. อิเล็กตรอนไม่ได้เคลื่อนที่เป็นวงกลม แต่เคลื่อนที่ไปรอบๆนิวเคลียส
เป็นรูปทรงต่างๆตามระดับพลังงาน
2. ไม่สามารถบอกตำแหน่งที่แน่นอนของอิเล็กตรอนไ้ด้ เนื่องจากอิเล็กตรอนมีขนาดเล็กมาก
และเคลื่อนที่รวดเร็วตลอดเวลาไปทั่วทั้งอะตอม
3. อะตอมประกอบด้วยกลุ่มหมอกของอิเล็กตรอนรอบนิวเคลียส บริเวณที่มีหมอกทึบ
แสดงว่ามีโอกาสพบอิเล็กตรอนได้มากกว่าบริเวณที่มีหมอกจาง ดังรูปที่แสดงไว้
2.2อนุภาคในอะตอมและไอโซโทป

























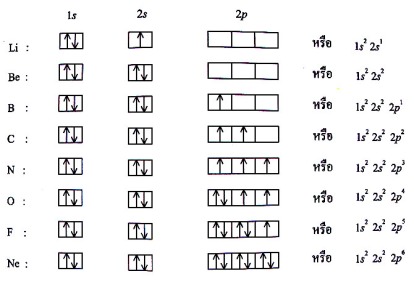





















 ตัวอย่างเลขออกซิเดชันของธาตุ
ตัวอย่างเลขออกซิเดชันของธาตุ
ไม่มีความคิดเห็น:
แสดงความคิดเห็น